Дифосген
| Дифосген | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
трихлорметиловый эфир хлормуравьиной кислоты |
| Традиционные названия | дифосген |
| Хим. формула | C₂Cl₄O₂ |
| Рац. формула | CCl3OCOCl |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 197,82 г/моль |
| Плотность | 1,65 г/см³ |
| Термические свойства | |
| Т. плав. | −57 °C |
| Т. кип. | 127,5 °C |
| Оптические свойства | |
| Показатель преломления | 1,4566 |
| Классификация | |
| Рег. номер CAS | 503-38-8 |
| PubChem | 10426 |
| Рег. номер EINECS | 207-965-9 |
| SMILES | |
| InChI | |
| RTECS | LQ7350000 |
| ChemSpider | 21154424 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дифосген — трихлорметиловый эфир хлормуравьиной кислоты.
Содержание
Свойства
Подвижная жидкость, без цвета, с характерным запахом прелого сена, на воздухе дымит. Хорошо растворим в органических растворителях (бензол, толуол, четыреххлористый углерод, ацетон), плохо растворим в воде.
Высокотоксичен, вызывает удушающее и раздражающее действие.
История
Впервые получен в 1847 году французским химиком О. Кауром. Во время Первой мировой войны в различных формах применялся обеими воюющими сторонами в качестве удушающего отравляющего вещества. Впервые был применен Германией в июле 1916 года против французских войск под Верденом.
Синтез
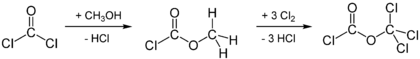
Промышленным методом синтеза дифосгена является хлорирование на свету метилхлорформиата, получаемого из фосгена и метанола:
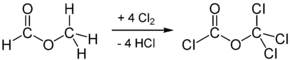
Дифосген также может быть синтезирован радикальным хлорированием метилформиата при облучении ультрафиолетом:
Химические свойства
При нагревании дифосген разлагается на две молекулы фосгена, этот процесс катализируется активированным углем, оксидом и хлоридом железа(III), хлоридом алюминия:
В случае использования в качестве катализатора оксида алюминия дифосген разлагается с образованием четыреххлористого углерода и диоксида углерода:
Применение
В Первой мировой войне применялся в качестве удушающего боевого отравляющего вещества.
Реагент в синтезе органических карбонатов, изоцианатов. Используется для получения фосгена в лабораторных условиях.
Биологическое значение
Дифосген является ядом удушающего действия для человека и других животных с замедленным по времени наступлением смерти. Симптомы отравления фосгеном и дифосгеном: мучительный кашель, выделение мокроты с примесью крови, посинение кожи (цианоз), отёк лёгких. Отравление может протекать незаметно для человека, поскольку первые симптомы отравления появляются только спустя несколько часов (5-12 часов с момента начала вдыхания малых концентраций фосгена или дифосгена). Обнаружить фосген или дифосген в воздухе можно по характерному «тухлому» запаху, похожему на запах прелого сена. Табачный дым в атмосфере даже с малой примесью фосгена или дифосгена меняет свой запах и для курящего становится неприятным, что может служить простым методом определения фосгена и дифосгена в воздухе. Отравление дифосгеном может произойти при авариях на предприятиях по производству различных пластмасс.